Blogi
Suomessa tarvitaan tutkimusnäyttöön perustuvaa keskustelua koronatesteistä
Koronaviruspandemian aikana keskustelu eri diagnostisten menetelmien ominaispiirteistä on ollut Suomessa keskuslaboratoriojohtoista ja PCR-dogma-vetoista. Nykyisen keskitetyn PCR-diagnostiikan strategian taustalla olevaa tutkimusnäyttöä ei ole avoimesti saatettu terveydenhuollon, päättäjien ja diagnostiikkayhteisön arvioitavaksi. Kansalaisten, terveydenhuollon, infektiontorjunnan ja kansantalouden edun vuoksi keskustelun tulisi perustua tutkimusnäyttöön. Lappia ja yksityistä terveydenhuoltoa lukuunottamatta antigeenipikatestit ovat olleet kansainväliseen tutkimusnäyttöön ja käytänteihin nähden rajusti alihyödynnettyjä. Pikatestien hyödyt on tyrmätty keskuslaboratoriojohtajien toimesta mm. vertaamalla niiden tarkkuutta kolikonheittoon (Lääkärilehti 33/2021, s. 1623).
Suomessa vallitsevan käsityksen mukaan ideaalin pikatestin herkkyys PCR:ään verrattuna pitäisi olla 100%. Tämä on väärinymmärrys. Pikatestien ei edes kuulu korreloida täysin PCR:n kanssa, koska menetelmät mittaavat eri asioita ja ne on suunniteltu eri tarkoituksiin (Mina 2021). Antigeenitestit on nimenomaisesti suunniteltu osoittamaan näytteestä infektiivinen virus hyödyntäen viruksen biologista monistumista kehossa (Guglielmi 2020). Antigeenitestit mittaavat poikkeuksetta infektiokykyisen viruksen rakenneproteiineja (nukleokapsidiproteiineja, ei pintaproteiineja kuten kirjoitettu Lääkärilehdessä 8/2021, s. 485). PCR-testit puolestaan mittaavat viruksen RNA:ta koeputkimonistumista hyödyntäen riippumatta, onko näytteen RNA seurausta infektiokykyisestä viruksesta, kaukaisen infektion pitkäkestoisesta RNA-erityksestä, altistuksesta tai kontaminaatiosta (Velavan 2021).
Kansainvälisen tutkimusnäytön mukaan laajasti käytössä olevien perinteisten tai automatisoitujen koronaviruspikatestien herkkyys (kyky löytää positiiviset tapaukset) on nenänielunäytteistä infektiivisten yksilöiden osoittamisessa käytännössä 100% (Pekosz 2021) ja PCR-geenimonistustestaukseen verrattuna 75-100% (Pekosz 2021, Koskinen 2021). Kaiken lisäksi tutkimusnäytön mukaan tärkeintä pandemiantorjunnassa tartuttajien löytämiseksi ja tartuntaketjujen pysäyttämiseksi on testauksen frekvenssi (kuinka usein testataan) ja tulosaika. Testauksen absoluuttisella herkkyydellä on vain vähän vaikutusta tehokkuuteen (US CDC 2021, Larremore 2021).
On vahva tieteellinen näyttö siitä, että antigeenitestit löytävät nimenomaan tartuttavat yksilöt olivat he sitten oireellisia tai oireettomia (Pekosz 2021, La Scola 2020), mikä on infektiontorjunnan kannalta tehokkainta ja tärkeintä (Laxminarayan 2020). Tartuttajien löytämisessä pikatesti on itse asiassa tarkempi (spesifisempi) kuin PCR, jossa jopa 25-50% löydöksistä voi olla testaushetkellä ei-infektiivisiä (Pekosz 2021). Tutkimusnäytön mukaan koronaviruspikatestien kyky erottaa negativiiset yksilöt on keskimäärin 99,9% (Stohr 2021, Koskinen 2021), ei suinkaan kolikonheittovertauksessa väitetty 50%. Positiiviseen pikatestitulokseen uskaltaa lähtökohtaisesti luottaa, eikä sitä säännönmukaisesti ole tarvetta varmistaa toisella menetelmällä. Turhien karanteenien välttämiseksi tutkimusnäyttö sen sijaan puoltaisi siis PCR-positiivisten varmistustestausta antigeenitestillä vain tartuttajien eristämiseksi.
Tutkimusnäyttöä antigeenitestien korkeammasta tarkkuudesta löytyy COVIDin lisäksi esimerkiksi influenssalle (Inagaki 2016). Herkät antigeenitestit toimivat lisäksi hyvin todennäköisten tartuttajien löytämisessä, vaikka oireiden alkamisesta olisi yli viikko (Nuttens 2021).
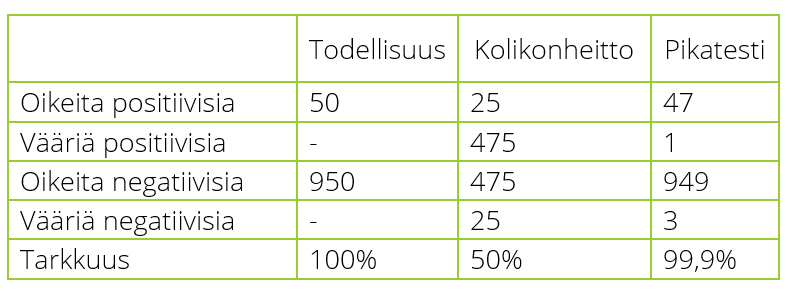
Pikatestien tarkkuutta ei ole asiallista verrata kolikonheittoon. Taulukossa 1. on esitetty testitulokset kolikkoa heittämällä ja pikatestiä käyttämällä 1000 näytteen aineistossa, jossa tosipositiivisten esiintyvyys on 5% ja pikatestin herkkyys 94%. Tarkastelu osoittaa kolikonheittovertauksen luovan vääristyneen kuvan antigeeniosoituksen suorituskyvystä ja hyödyllisyydestä.
Taulukko 1. Testitulokset kolikkoa heittämällä tai käyttämällä pikatestausta.
Tieteellinen tutkimusnäyttö puoltaa diagnostiikan osalta vahvasti erilaista pandemiantorjuntastrategiaa, kuin Suomessa on toteutettu. Pikatestauksella olisi mahdollista päästä jälkiseurannasta (kuka tartutti kenet) tartuntojen ennaltaehkäisyyn. Olisi kohtuullista, että alkuperäisen testausstrategian taustalla oleva mahdollinen tutkimusnäyttö esiteltäisiin arvioitavaksi. Peräänkuulutamme avointa, tieteeseen perustuvaa keskustelua ja alkuperäistutkimuksia eri diagnostiikkamenetelmien ominaispiirteistä ilman ennakkoasenteita. Oireettomien testauksessa voitaisiin harkita myös itse toteutettua näytteenottoa (Nuttens 2021, Stohr 2021) erityisesti, jos vaihtoehtona on esimerkiksi rajoilla resurssipulan takia testaamatta jättäminen.
Janne O. Koskinen, FT (infektiotautien in vitro -diagnostiikka ja biofysiikka), Tutkimus- ja tuotekehitysjohtaja, ArcDia International Oy
Juha M. Koskinen, FM (in vitro -diagnostiikka), Tutkimus- ja tuotekehityskemisti, ArcDia International Oy
Lue myös sisarartikkeli Lääkärilehdestä (tiivistelmä on-line, varsinainen artikkeli 37/2021 S. 1944-1955).
VIITTEET
Guglielmi G. Fast coronavirus tests: what they can and can’t do. Nature. 2020;585:496-498.
Inagaki K, Song M-S , Crumpton J-C ym. Correlation Between the Interval of Influenza Virus Infectivity and Results of Diagnostic Assays in a Ferret Model. J Infect Dis 2016;213:407-410
Koskinen JM, Antikainen P, Hotakainen K ym. Clinical Validation of Automated and Rapid mariPOC SARS-CoV-2 Antigen Test. Manuscript submitted. Pre-publication doi: 10.21203/rs.3.rs-513348/v1, https://www.researchsquare.com/article/rs-513348/v1.
La Scola B, Le Bideau M, Andreani J ym. Viral RNA load as determined by cell culture as a management tool for discharge of SARS-CoV-2 patients from infectious disease wards. Eur J Clin Microbiol Infect Dis. 2020;39:1059-1061.
Larremore DB, Wilder B, Lester E ym. Test sensitivity is secondary to frequency and turnaround time for COVID-19 screening. Sci Adv. 2021;7(1):eabd5393. doi: 10.1126/sciadv.abd5393.
Laxminarayan R, Wahl B, Dudala SR ym. Epidemiology and transmission dynamics of COVID-19 in two Indian states. Science 2020;370:691-697.
Mina MJ, Andersen KG. COVID-19 testing: One size does not fit all. Science. 2021;371:126-127.
Nuttens J, Goswami M, Antikainen P ym. Monitoring of SARS-CoV-2 infection from NP swab, saliva, feces and urine by a quantitative rapid antigen test. 37th Annual meeting of the Nordic Society of Clinical Microbiology and Infectious Diseases (NSCMID), 3-6 September 2021, Turku, Finland. Poster, abstract, and audio presentation #39.
Pekosz A, Parvu V, Li M ym. Antigen-Based Testing but Not Real-Time Polymerase Chain Reaction Correlates With Severe Acute Respiratory Syndrome Coronavirus 2 Viral Culture. Clin Infect Dis. 2021: ciaa1706. doi: 10.1093/cid/ciaa1706
Stohr JJJM, Zwart VF, Goderski G ym. Self-testing for the detection of SARS-CoV-2 infection with rapid antigen tests for people with suspected COVID-19 in the community. Clin Microbiol Infect. 2021;S1198-743X(21)00434-1. doi: 10.1016/j.cmi.2021.07.039.
US CDC. 2021. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2, https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html tarkasteltu 27.4.2021
Velavan TP, Meyer CG. Editorial. COVID-19: A PCR-defined pandemic. Int J Infect Dis. 2021;103:278-279.